Dos estudios publicados en la revista ‘New England Journal of Medicine’ describen los primeros tratamientos realizados hasta la fecha, de los que han nacido ocho bebés por donación mitocondrial, o la técnica de los tres padres Leer Dos estudios publicados en la revista ‘New England Journal of Medicine’ describen los primeros tratamientos realizados hasta la fecha, de los que han nacido ocho bebés por donación mitocondrial, o la técnica de los tres padres Leer
Uno de cada 5.000 bebés nace con mutaciones heredadas que se convierten en enfermedades incurables. Estas se debes a fallos en el ADN mitocondrial, la parte de la célula cuya tarea principal es la producción de la energía necesaria para la vida y cuyo pequeño fragmento genético solo codifica algunas de las instrucciones necesarias para dicho encargo. La alteración genética en este sistema impacta en tejidos con una elevada demanda energética, como el corazón, los músculos y el cerebro. O lo que es lo mismo, en el desarrollo de trastornos neuromusculares graves, así como problemas de fertilidad.
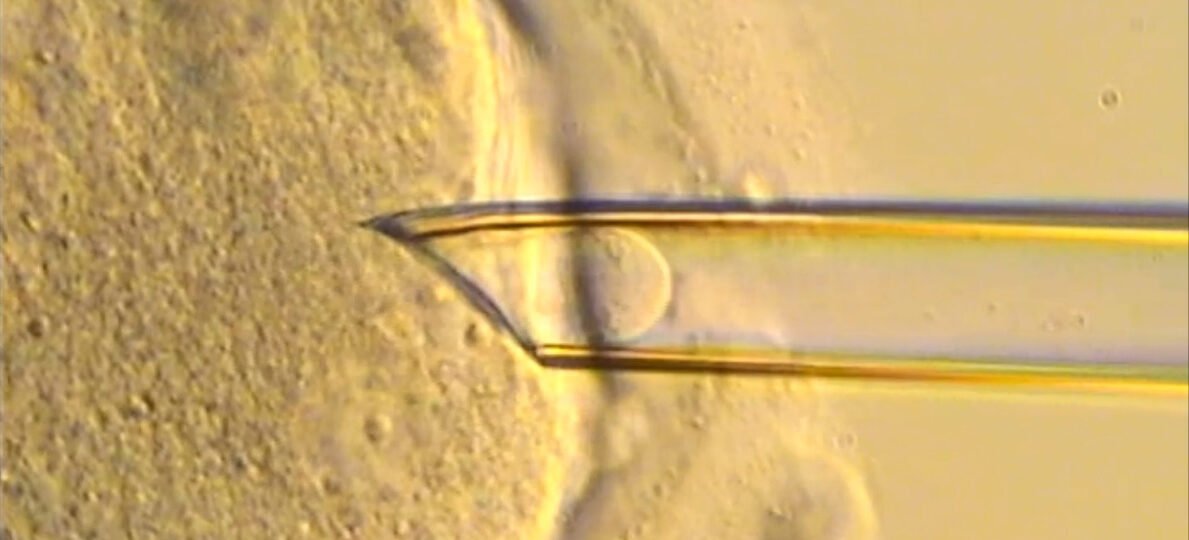
Una forma de abordar ese fallo es ir al origen en el momento de la concepción, «porque se heredan únicamente de la madre. Aunque los varones pueden verse afectados, no transmiten la enfermedad», explica Emilio Gómez, embriólogo y director del Laboratorio de reproducción asistida en Next Fertility Murcia. Desde hace un tiempo, se han publicado diversos trabajos que hacen hincapié en el uso de las técnicas de trasplante de mitocondrias para prevenir la transmisión de estas enfermedades. «Básicamente, se trataría de reemplazar las mitocondrias enfermas de un óvulo o cigoto (óvulo fecundado) por otras sanas provenientes de una donante. Esto, aunque parece fácil, no lo es», apunta Gómez. También se conoce como la técnica de los tres padres.
Ahora dos estudios publicados en la revista New England Journal of Medicine (NEJM) describen los resultados de los primeros tratamientos realizados hasta la fecha, de los que han nacido ocho bebés por donación mitocondrial, con una reducción del riesgo de enfermedad. La nueva tecnología basada en la fecundación in vitro (FIV), la transferencia pronuclear legalizada en el Reino Unido en 2015, está diseñada para reducir el riesgo de enfermedades del ADN mitocondrial en hijos de mujeres portadoras de altos niveles de mutaciones patógenas.
El equipo de Newcastle, que dio los primeros pasos, ha incluido ahora la transferencia pronuclear en un estudio de investigación junto a una gama de opciones reproductivas para mujeres con riesgo de transmitir estos fallos. Mary Herbert, profesora de Biología Reproductiva en la Universidad Monashy, embrióloga en el Centro de Fertilidad de Newcastle y coautora de la investigación presentaba los datos que avalan la técnica, «ya que se necesitaba un ensayo clínico que midiera el éxito». «Hemos logrado silenciar la alteración hasta hacerla imperceptible y que no se tradujera en enfermedad», apuntaba.
En seis de los ocho bebés nacidos, se logró reducir en más del 95% la presencia de variantes patógenas del ADN mitocondrial; en los otros dos, la reducción fue del 77% al 88%. «Gracias a este increíble avance, la carga emocional de la enfermedad mitocondrial se ha aliviado. Ahora hay esperanza, alegría y gratitud», apunta una madre de uno de los niños en un comunicado.
Hace una década Reino Unido daba un paso adelante clave para trazar un camino hacia la eliminación de las enfermedades transmitidas por los fallos en el ADN mitocondrial. Los ingleses elaboraron una iniciativa pionera a nivel mundial, tras un amplio debate público y una revisión científica y ética: dieron luz verde para que la Autoridad de Fertilización Humana y Embriología (HFEA) permitiera tratamientos de donación de mitocondrias a mujeres con alto riesgo de transmitir enfermedades graves del ADN mitocondrial a sus hijos. Tras esto, la ley ha cambiado en Australia.
Entonces, el Centro de Fertilidad de Newcastle, perteneciente a la Fundación del Servicio Nacional de Salud (NHS) de los Hospitales de Newcastle, obtuvo la primera licencia para realizar donación clínica de mitocondrias mediante transferencia pronuclear en 2017. Se estableció una vía clínica con médicos especialistas en mitocondrias como parte del Servicio Altamente Especializado del NHS de Inglaterra.
Todo el proceso gira alrededor de dos procesos: conocer la situación previa y corregir. La primera parte se lleva a cabo a través del diagnóstico genético preimplantacional (PGT), un procedimiento que ayuda a las parejas a evitar la transmisión de enfermedades genéticas a sus hijos. Este paso adicional analiza los embriones para detectar enfermedades genéticas.
Y, en segundo lugar, la transferencia pronuclear (PNT) consiste en transferir el ADN nuclear de un óvulo fecundado a un óvulo fecundado de donante para prevenir la transmisión de enfermedades del ADN mitocondrial (ADNmt).
El programa que da forma al ensayo clínico se dirigió a mujeres portadoras de de mutaciones mitocondriales. «Los resultados son motivo de optimismo», subraya Herbert. Sin embargo, «será esencial seguir investigando para comprender mejor las limitaciones de las tecnologías de donación mitocondrial con el fin de mejorar aún más los resultados del tratamiento», añade la embrióloga.
Otro de los autores de la Universidad de Newcastle, Douglas M. Turnbull, profesor emérito de Neurología, recordó a los medios los primeros casos identificados: el árbol genealógico de Sharon y la herencia patológica de una acidosis láctica grave. «Perdió a su hijo Eduard en 2011 a la edad de 21 años». Con este ejemplo, Turnbull buscaba dibujar la devastadora situación para algunas familias.
Para Turnbull en el proceso han jugado un papel clave tanto los investigadores, como las familias y la Fundación Verlidge, «que ha hecho posible todo el proceso de la mano de los pacientes».
Sobre la técnica empleada, Gómez detalla que «se ha realizado, por primera vez, una comparación de dos técnicas diferentes para intentar evitar la transmisión de enfermedades mitocondriales. Por un lado, se ha realizado una transferencia de pronúcleos del ovocito con todas sus mitocondrias defectuosas (variante homoplásmica) a un ovocito de una donante con las mitocondrias sanas, y por otro, se ha utilizado el diagnóstico genético preimplantacional (PGT) para determinar el número de copias de mitocondrias en embriones procedentes de ovocitos que presentaban más del 30% de las mitocondrias dañadas (variante heteroplásmica), y poder así transferir a las pacientes embriones que tengan bajos niveles de variantes patógenas de las mitocondrias».
El embriólogo de Next Fertility sostiene que «este trabajo incrementa el conocimiento de este tipo de técnicas que ofrece una opción reproductiva segura para mujeres que presenten variantes homoplásmicas o heteroplásmicas de alto grado».
La madre de una niña nacida tras una donación mitocondrial declaró: «Como padres, siempre quisimos darle a nuestra hija un comienzo saludable en la vida. La FIV con donación mitocondrial lo hizo posible. Tras años de incertidumbre, este tratamiento nos dio esperanza y, finalmente, nos dio a nuestro bebé. Ahora los vemos llenos de vida y posibilidades, y estamos abrumados por la gratitud. La ciencia nos dio una oportunidad», como recoge un comunicado oficial.
Otra madre de un niño añadió que «ahora somos orgullosos padres de un bebé sano: un verdadero éxito de la donación mitocondrial. Este avance ha disipado el temor que nos agobiaba«. Al tiempo agradeció el avance y el apoyo durante el proceso, «la carga emocional de la enfermedad mitocondrial se ha aliviado, y en su lugar hay esperanza, alegría y una profunda gratitud».
A través del Science Media Center, distintos expertos a nivel mundial se han posicionado sobre este avance. En nuestro país, Rocío Núñez Calonge, directora científica del Grupo UR Internacional y coordinadora del Grupo de Ética de la Sociedad Española de Fertilidad, apunta que «el estudio también plantea interrogantes éticos y científicos. La combinación de ADN nuclear y mitocondrial de distintas personas podría tener efectos a largo plazo aún desconocidos. Por ello, los investigadores subrayan la necesidad de realizar un seguimiento riguroso de estos niños, que en este caso se extenderá hasta los cinco años de edad. Además, insisten en que este procedimiento solo debe aplicarse cuando no existan otras alternativas reproductivas viables».
En un plano más positivo, Santiago Restrepo Castillo, ingeniero biomédico, investigador posdoctoral en la Universidad de Texas en Austin (EEUU), asegura que «será emocionante ver si los beneficios se mantienen a lo largo del tiempo, y será fundamental seguir desarrollando este proceso integrado para aumentar sus tasas de éxito».
Por su parte, Lluís Montoliu, investigador en el Centro Nacional de Biotecnología (CNB-CSIC) y en el CIBERER-ISCIII, analiza la laguna legal que hay en nuestro país y pide un paso valiente hacia su legalización. «En España, nuestra Ley 14/2006, de 26 de mayo, sobre técnicas de reproducción humana asistida, no se refiere explícitamente a esta técnica (que no existía cuando se aprobó esta legislación) por lo que sensu stricto el procedimiento no estaría expresamente prohibido ni explícitamente autorizado en nuestro país». Al tiempo, señala las dudas legales y éticas son las barreras que lo han impedido hasta el momento.
En este sentido, Montoliu subraya que los resultados cosechados deberían dar cobertura a «la técnica para parejas en las que la madre es portadora de mitocondrias afectadas para poder tener descendencia libre de las terribles enfermedades mitocondriales. Personalmente creo que deberíamos permitir esta técnica en nuestro país en aquellas clínicas de reproducción asistida que tuvieran la formación adecuada en esta sofisticada metodología de intervención embrionaria».
«Supone un avance significativo en genética preventiva, así como en medicina reproductiva, ya que su futura aplicación, de esta o de otras técnicas similares, mejoraría las posibilidades de tener hijos sanos para muchas familias afectadas por enfermedades mitocondriales», remacha Gómez.
Salud // elmundo